Negli ultimi decenni, nel mondo del wound care, è emerso un nemico invisibile ma potente, che ha rivoluzionato la nostra comprensione delle lesioni difficili: il biofilm.
Identificato tra i principali responsabili della cronicizzazione delle lesioni, il biofilm batterico è diventato oggetto di crescente attenzione da parte della comunità scientifica, che sta investendo energie e risorse per contrastarne la diffusione.
Comprendere che cos’è, come si forma il biofilm, il suo ruolo nelle lesioni cutanee e le strategie per eliminarlo, è oggi una delle conoscenze basilari per la gestione delle lesioni di difficile guarigione come le ulcere e le ferite chirurgiche infette.
Indice
Che cos’è il biofilm batterico?
Il biofilm è un aggregato batterico formato da microrganismi immersi in una matrice polisaccaridica extracellulare, utile ad aderire e colonizzare una superficie organica come un lesione cutanea o una superficie inorganica come il materiale di dispositivi medici, tra cui cateteri venosi e vescicali, protesi articolari, pacemaker e defibrillatori cardiaci (Jamal, 2018).
Lo scopo di questa struttura batterica è aumentare la sopravvivenza delle comunità batteriche che vi partecipano, grazie alla difesa della sostanza polimerica in cui sono inglobate.
Elementarmente, il biofilm è composto, fino a un terzo della sua massa, di componente vivente, tra cui batteri ma anche funghi e altri microrganismi, per il resto da una matrice costituita in minor parte da sostanze organiche, polisaccaridi (zuccheri), proteine, DNA libero e tracce di sostanze inorganiche come ioni metallici, minerali ed enzimi, e infine, principalmente, di acqua.
Possiamo immaginare il biofilm come un enorme condominio in cui un numero di altrettante persone, di etnia e nazionalità diverse, ha deciso di convivere per sopravvivere a una guerra che rischiava di sterminarli. Tra gli agenti che possono minacciare questi “condomini” abbiamo antibiotici, raggi ultravioletti, leucociti e altre cellule immunitarie.
La formazione di questa configurazione batterica è un processo non ancora perfettamente compreso in tutta la sua affascinante totalità, ma è comunque possibile riassumere alcune delle fasi che portano cellule libere di spostarsi dalla forma planctonica (libere di muoversi nell’ambiente) a quella sessile (in forma aggregata), ed organizzarsi in strutture così complesse come quella del biofilm.
Qual è il ruolo del biofilm nelle lesioni cutanee?
In realtà, dell’aggregazione batterica sessile e dell’adesione alla superficie dei denti come forma di sistema di protezione dagli agenti a loro patogeni era noto già dalla fine del 1600.
Tuttavia, solo negli anni ’70, grazie all’accesso a tecnologie di microscopia più avanzate e alla microbiologia tradizionale, si comprese l’ubiqua presenza batterica organizzata su superfici diverse, come lo stomaco bovino e i corsi d’acqua alpini.
Oggi, il biofilm è ormai individuato e implicato in numerose infezioni batteriche, tra cui quelle associate al tratto urinario, alle infezioni correlate a dispositivi medici come i cateteri venosi e, ovviamente, alle lesioni di difficile guarigione.
Proprio in questo contesto scientifico emerse per la prima volta il termine “biofilm” (/baɪ.əʊ.fɪlm/ oppure “bai-ow-film”), utilizzato per descrivere comunità batteriche aderenti alle superfici sia organiche che inorganiche, racchiuse e protette da un glicocalice autoprodotto, noto come sostanza polimerica extracellulare (EPS), distinguendo definitivamente i batteri in stato planctonico, liberi di muoversi, spostarsi, replicarsi e diffondersi in un liquido, da quelli in stato sessile, ovvero colonie organizzate e vincolate l’una all’altra tramite organizzazioni strutturate di microrganismi che esprimono un fenotipo di quiescenza, anche di specie diverse, racchiusi in una matrice polimerica resistente agli agenti a loro patogeni.
Tra i batteri che si organizzano più spesso in biofilm e più comunemente riscontrati sulle lesioni difficili possiamo riscontrare la presenza di Staphylococcus aureus, Proteus mirabilis e Pseudomonas aeruginosa (Donelli, 2005).
Secondo il National Institute of Health, istituto di ricerca facente parte del Dipartimento americano della Salute, fino all’80% delle infezioni possono essere correlate alla formazione di biofilm (Jamal, 2018; Sen, 2021).
La World Union of Wound Healing Societies si spinge oltre, ipotizzando che a causa dei limiti delle tecniche di campionamento microbiologico, questo dato potrebbe avvicinarsi al 100% dei campioni di lesioni che non guariscono (WUWHS, 2016).
A suggellare questa ipotesi, anche un comitato di esperti raccolto attorno a una strategia di gestione del biofilm chiamata Wound Hygiene ha definitivamente concordato che “quasi tutte le lesioni di difficile guarigione contengono biofilm” (Murphy, 2020).
In base a queste affermazioni, l’operatore che si confronta con una ferita che non guarisce nonostante il trattamento deve prendere in considerazione l’alta probabilità di trovarsi di fronte a una lesione cutanea con biofilm e che, per rimettere in moto il processo di guarigione e reindirizzare il tessuto lesione verso la riepitelizzazione, il biofilm deve quindi essere interrotto e rimosso (Metcalf, 2013).
Questo obiettivo richiede tutta una serie di interventi che approfondiamo in altri articoli, ma prima di capire come contrastare questo fenomeno, sarà necessario comprenderlo a fondo e scoprire, innanzitutto, come nasce, si replica e instaura questa matrice di aggregato batterico nella lesione cutanea, tanto da renderla di difficile guarigione.
Come si forma un biofilm?
Un’indagine particolarmente significativa che fu condotta negli anni 70′ su rocce di granito in un corso d’acqua alpino canadese scoprì che la popolazione batterica presente in uno strato di melma scivolosa sulle superfici rocciose era dalle 1.000 alle 10.000 volte superiore rispetto ai batteri planctonici presenti nell’acqua sovrastante.
Questo dato dimostrava chiaramente la tendenza dei batteri ad aderire alle superfici (Geesey, 1977; Metcalf, 2013) e quanto sia vantaggiosa per i microrganismi la strategia che li spinge dalla forma libera a esprimere fenotipi sessili e quindi organizzarsi in biofilm, anche in stretta vicinanza con specie diverse tra loro. Ma come si forma un biofilm? La risposta è estremamente affascinante, quasi quanto il suo impatto nella salute dei nostri pazienti.
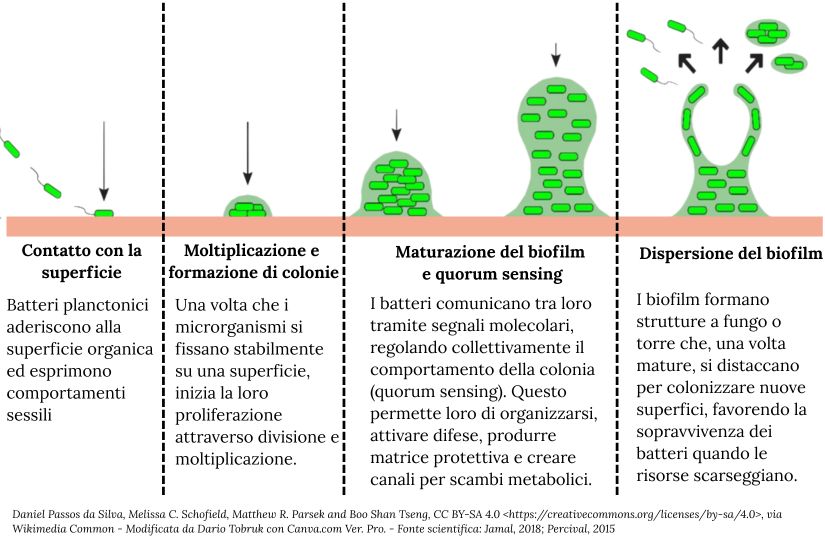
Prima fase: contatto con la superficie
In questa prima fase i batteri, attraverso appendici come pili e flagelli, aderiscono alla superficie in cui sono approdati (organica o inorganica) con l’intento di attecchire con quante più forze elettro-chimiche possibili (idrofobicità, interazioni elettrostatiche ed elettromagnetiche) per insediarsi in maniera irreversibile con il passare del tempo.
L’adesione si completa nell’arco di circa 48 ore attraverso la formazione del biofilm, che aderisce tramite interfacce liquido-solido tra cellule e cellule e superficie.
Seconda fase: moltiplicazione e formazione di colonie
Una volta che i microrganismi sono attaccati su una superficie (biotica o abiotica) e questo approdo diventa definitivamente stabile inizia un processo di divisione e moltiplicazione batterica (Jamal, 2018).
Terza fase: maturazione del biofilm e quorum sensing
Quando la colonia batterica cresce, aumentano anche i segnali molecolari chiamati autoinduttori, che permettono ai batteri di organizzarsi, coordinarsi e decidere, ad esempio, se produrre la matrice, rallentare il metabolismo o smettere di replicarsi.
Questo processo è chiamato quorum sensing: ogni batterio produce un certo tipo di molecola, e quando il segnale raggiunge una soglia, tutta la colonia risponde in modo sincronizzato.
Un altro aspetto interessante di questa fase è l’uso degli spazi tra cellule che emergono spontaneamente dalla produzione irregolare della matrice polimerica da parte dei batteri stessi, con alcune aree più dense e altre più vuote, che diventano veri e propri canali di passaggio per ossigeno, nutrienti e scarti.
Come un rudimentale sistema circolatorio, questi involontari passaggi d’acqua permettono lo scambio metabolico delle cellule con l’esterno e l’ambiente circostante e la comunicazione biomolecolare tra cellule ( Jamal, 2018; Percival, 2015).
Quarta fase: dispersione del biofilm
Queste formazioni di biofilm producono delle strutture a fungo o a torre, in modo che, una volta che gli apici siano sufficientemente maturi, possano staccarsi agevolmente e colonizzare le superfici attorno al campo madre.
La dispersione (o dispersal) è una strategia necessaria per i microrganismi, soprattutto quando le risorse sono scarse e la densità cellulare è elevata, aumentando le possibilità delle specie di sopravvivere sia nella forma sessile che in quella planctonica (Jamal, 2018; Percival, 2015).
Come si elimina il biofilm dalle lesioni cutanee?
L’impatto del biofilm sulle lesioni cutanee è quindi considerevole, per il fatto che la sua presenza favorisce il persistere dell’infiammazione, ostacola la risposta immunitaria sul tessuto e l’azione degli antibiotici e degli antisettici, impedisce la granulazione e la riepitelizzazione e, in definitiva, cronicizza lo stato non-healing della lesione, rendendola di difficile guarigione (Bowler, 2016).
Ad oggi, il paradigma più efficace per l’eliminazione del biofilm dalle lesioni cutanee e condiviso dalla comunità scientifica nel mondo wound care è quello di effettuare un frequente debridement (vedi articolo) e disgregare la matrice polimerica in cui sono immersi i batteri che lo compongono per esporre i microrganismi in forma planctonica (e quindi non protetti dalla colonia) all’attività di agenti antimicrobici (Wolcott 2010).
Inoltre, tramite la continua riduzione del biofilm per mezzo del debridement continuo, prevenire la nuova generazione tramite medicazioni avanzate a base di sostanze antimicrobiche (WUWHS, 2016).
La presenza di biofilm, infatti, crea un ambiente favorevole alla cooperazione tra microrganismi, che possono scambiarsi nutrienti, metaboliti e persino informazioni, formando comunità batteriche strutturate.
Qual è il trattamento più raccomandato per eliminare il biofilm?
Tra i materiali più usati per eliminare il biofilm dalle lesioni cutanee la clinica dispone di numerosi prodotti, tra cui disinfettanti acidi come l’acido ipocloroso o alogeni come lo iodio, tecnologie a base di metalli come gli ioni d’argento, medicazioni avanzate, soluzioni tensioattive e disinfettanti come i combinati poliesametilene biguanide (PHMB) e betaine, agenti che agiscono fisicamente come le garze di dialchilcarbamoilcloruro (DACC), e numerosi altre tipologie di prodotti.
Per un approfondimento di questo argomento vi invitiamo a rivedere il webinar che vi proponiamo nel video qui sotto, incentrato sulla disciplina del wound care, e arricchito dall’intervento di professionisti di diverse discipline come infermieri, biologi e farmacisti.
Autore: Dario Tobruk (seguimi anche su Linkedin – Facebook – Instagram – Threads)
Fonti scientifiche dell’articolo:
- Donelli G., Guaglianone E., Antonelli M., Fadda G., Ierna A., Salvia A. 2005. Infezioni associate alle ulcere da pressione: metodologie di prevenzione, diagnosi e trattamento.iii, Istituto Superiore di Sanità. Rapporti ISTISAN 05/41. 23 p. [https://www.iss.it/documents/20126/45616/06-46.1170945560.pdf/90992e43-ca8d-a306-ab94-56fbb4341748?version=1.4&t=1581098339742&download=true]
- Jamal M, Ahmad W, Andleeb S, Jalil F, Imran M, Nawaz MA, Hussain T, Ali M, Rafiq M, Kamil MA. Bacterial biofilm and associated infections. J Chin Med Assoc. 2018 Jan;81(1):7-11. doi: 10.1016/j.jcma.2017.07.012. Epub 2017 Oct 15. PMID: 29042186.
- Sen CK, Roy S, Mathew-Steiner SS, Gordillo GM. Biofilm Management in Wound Care. Plast Reconstr Surg. 2021 Aug 1;148(2):275e-288e. doi: 10.1097/PRS.0000000000008142. PMID: 34398099; PMCID: PMC8439557.
- World Union of Wound Healing Societies (WUWHS), Congresso di Firenze, Documento di posizionamento. Gestione del biofilm. Wounds International 2016 [Link]
- Murphy C, Atkin L, Swanson T, Tachi M, Tan YK, de Ceniga MV, Weir D, Wolcott R, Ĉernohorská J, Ciprandi G, Dissemond J, James GA, Hurlow J, Lázaro MartÍnez JL, Mrozikiewicz-Rakowska B,
- Wilson P. Defying hard-to-heal wounds with an early antibiofilm intervention strategy: wound hygiene. J Wound Care. 2020 Mar 1;29(Sup3b):S1-S26. doi: 10.12968/jowc.2020.29.Sup3b.S1. PMID: 32160083.
- Metcalf DG, Bowler PG. Biofilm delays wound healing: A review of the evidence. Burns Trauma. 2013 Jun 18;1(1):5-12. doi: 10.4103/2321-3868.113329. PMID: 27574616; PMCID: PMC4994495.
- Geesey GG, Richardson WT, Yeomans HG, Irvin RT, Costerton JW. Microscopic examination of natural sessile bacterial populations from an alpine stream. Can J Microbiol. 1977 Dec;23(12):1733-6. doi: 10.1139/m77-249. PMID: 340020.
- Bowler, P. G., & Parsons, D. (2016). Combatting wound biofilm and recalcitrance with a novel anti-biofilm Hydrofiber® wound dressing. Wound Medicine, 14, 6–11. https://doi.org/10.1016/j.wndm.2016.05.005
- Wolcott RD, Rumbaugh KP, James G, Schultz G, Phillips P, Yang Q, Watters C, Stewart PS, Dowd SE. Biofilm maturity studies indicate sharp debridement opens a time- dependent therapeutic window. J Wound Care. 2010 Aug;19(8):320-8. doi: 10.12968/jowc.2010.19.8.77709. PMID: 20852503.


















Scrivi un commento
Accedi per poter inserire un commento